Hepatocarcinoma
Tratamiento del HCC
Tratamiento del HCC
Desgraciadamente, el diagnóstico de HCC se hace con frecuencia cuando los pacientes presentan síntomas y tienen algún grado de insuficiencia hepática. En esta fase tardía, es difícil poder ofrecer un tratamiento eficaz que mejore la supervivencia. Por ello se ha de insistir en la realización cada seis meses del screening en los pacientes diagnosticados de cirrosis.
Se ha de tener en cuenta que la morbilidad asociada con la terapia puede ser elevada y algunos pacientes no serían debidamente seleccionados. Según estudios de Estados Unidos, más de la cuarta parte de los diagnosticados de HCC no sabían que tenían una enfermedad hepática antes del diagnóstico. Con la detección y la vigilancia adecuadas, muchos más pacientes podrían ser diagnosticados en etapas precoces de la enfermedad y con función hepática preservada.
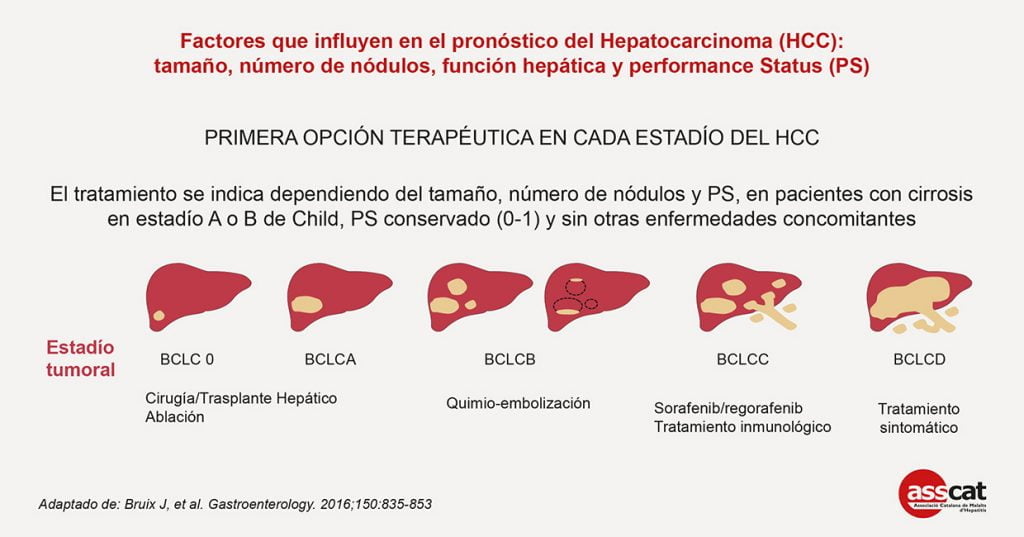
Actualmente, existen varias opciones de tratamiento, tanto quirúrgicas como no quirúrgicas, que tienen un impacto positivo en la supervivencia. Los mejores resultados se logran cuando los pacientes son cuidadosamente seleccionados para cada opción de tratamiento. Independientemente del enfoque terapéutico, los pacientes con HCC requieren una evaluación multidisciplinar en su atención para asegurar un resultado óptimo. El equipo multidisciplinar está compuesto por hepatólogos, radiólogos, patólogos, oncólogos, médicos, radiólogos intervencionistas, cirujanos hepatobiliares y de trasplante y equipos de enfermería. Cada especialidad con sus contribuciones permite asegurar en los pacientes con HCC unos resultados óptimos a largo plazo.
Tratamientos Quirúrgicos
- Resección Tumoral
La resección quirúrgica es el tratamiento de elección aceptado para los pacientes no cirróticos y ofrece una tasa curativa correcta con una supervivencia a 5 años del 75%-41%. La resecabilidad del tumor depende del tamaño del tumor, la localización, la función hepática subyacente y también va a depender de que el volumen del hígado restante asegure un funcionalismo suficiente que permita la resección sin aumentar las complicaciones ni la mortalidad posresección.
La resección se considera el tratamiento de primera línea siempre y cuando se pueda realizar con garantías de resección total del tumor. Los candidatos a esta terapia son pacientes con un tumor solitario confinado al hígado, ninguna evidencia radiológica de invasión vascular y función hepática excelente. La selección óptima de los candidatos es crucial para limitar la morbimortalidad quirúrgica. En pacientes con función hepática normal, el tamaño del tumor no afecta necesariamente al resultado cuando el volumen residual (volumen del hígado remanente) es adecuado y los aspectos técnicos de la cirugía son alcanzables. La mortalidad operatoria teórica que se calcula del 5% en caso de no cirrosis aumenta al 10% por la existencia de cirrosis.
En las pasadas décadas se utilizó la clasificación de Child-Pugh para documentar si se podía realizar una resección a los posibles candidatos. Sin embargo, la clasificación de Child-Pugh no es tan precisa como para predecir una insuficiencia hepática posoperatoria y algunos autores sostienen que los pacientes clasificados como Child-Pugh A pueden tener ya insuficiencia hepática funcional, hipertensión portal significativa y problemas de retención de líquidos incluso pueden requerir diuréticos. Utilizando la puntuación MELD (ver tabla 3) se ha demostrado que con un MELD igual o menor a 8 no existe mortalidad en comparación con una mortalidad perioperatoria del 29% para una puntuación igual o mayor a 9.
La viabilidad de la cirugía o el grado de posible resección hepática puede determinarse con el test de retención del colorante de indocianina, el cual no está disponible en todos los centros. Muchos grupos japoneses se basan en dicha prueba para evaluar si la cirugía es posible. En nuestro medio, la selección de los candidatos ideales para la resección se basa generalmente en el estudio de la hipertensión portal, que se evalúa mediante una técnica radiológica que permite la canulación de la vena hepática y el cálculo del gradiente de presión entre la vena porta y la vena cava. La hipertensión portal es evidente cuando el gradiente porto-caval es mayor de 10 mmHg. Un gradiente significativo también puede ser clínicamente estimado si hay evidencia de varices gastroesofágicas, esplenomegalia y un recuento plaquetario menor de 100.000. Ello conduce a un aumento de la morbilidad y mortalidad posoperatoria.
La embolización de la vena porta preoperatoria (EVP) es una técnica utilizada con la finalidad de favorecer la hipertrofia del hígado remanente residual, permitiendo así una resección hepática más extensa. Cuando se realiza la EVP, se puede lograr un aumento global del volumen del hígado del 10-12%. Se ha demostrado que la EVP preoperatoria tiene menos complicaciones importantes (10% vs. 36%) y mortalidad a 90 días (0% vs. 18%) en comparación con los pacientes que han sufrido una resección mayor sin EVP.
Como ya se ha mencionado, las tasas de supervivencia a los 5 años oscilan entre el 41% y el 75% para los pacientes que tienen un tumor solitario confinado al hígado sin evidencia radiológica de invasión vascular y función hepática preservada. En contraste, los pacientes que presentan hipertensión portal significativa sufrirán descompensación en el posoperatorio con una tasa de supervivencia estimada a los 5 años de menos del 50%. Por último, la supervivencia en pacientes que presentan tanto predictores adversos (hipertensión portal y bilirrubina elevada) como en casos de tumor multifocal la supervivencia sería menor al 30% a los 5 años.
En pacientes cirróticos se ha comunicado una tasa de mortalidad preoperatoria estimada entre el 3% y el 8% después de la resección y la tasa de supervivencia se halla entre el 30% y el 50% a los 5 años. A pesar del aumento de la supervivencia global en los pacientes sometidos a resección hepática (RH) para tratar el HCC, la supervivencia libre de enfermedad no ha cambiado. Las tasas de recurrencia pueden llegar al 70% después de 5 años. Los predictores de recurrencia temprana incluyen niveles de AFP de más de 2.000 ng/dL, resección no anatómica, invasión micro o macrovascular, márgenes de resección positivos y tumores poco diferenciados.
Existe la posibilidad de desarrollar un “tumor de novo” después de la resección (debido a que persiste la cirrosis de base y aparecen nuevos HCC). La mayoría de las recidivas del HCC ocurren después de 1-2 años y se cree que se producen por la diseminación o micrometástasis del tumor primario y no por una resección quirúrgica inadecuada. Las contraindicaciones a la resección son la presencia de metástasis extrahepáticas o invasión del tronco principal de la vena porta por el tumor. En general, la invasión neoplásica de la vena porta que conduce a la trombosis es un indicador de mal pronóstico.
En comparación con la cirugía abierta tradicional, la resección laparoscópica del hígado es segura y efectiva en pacientes cirróticos seleccionados y actualmente juega un papel clave en el tratamiento de HCC. La resección es también el tratamiento primario para los tumores avanzados y puede utilizarse como una alternativa o puente para el trasplante hepático. El único factor limitante al ofrecer la resección laparoscópica frente a la abierta es que dicha técnica sea factible.
- Trasplante hepático
En medicina, uno de los objetivos principales es evaluar y cuantificar el beneficio de un tratamiento para una enfermedad con el fin de evitar daños potenciales y conocer tanto si el riego es mayor con tratamiento que sin él. También conviene saber si se desperdician recursos y conocer que los beneficios son significativos. Esto es especialmente importante cuando hablamos de trasplante de órganos, donde la complejidad de los principios éticos relacionados con la equidad, la justicia, la utilidad, la autonomía y la beneficencia hacen difícil la asignación de recursos.
El Trasplante Hepático (TH) es la mejor opción curativa para los pacientes con cirrosis descompensada y HCC. El HCC es el único tumor sólido que puede ser tratado con un trasplante.
Mazzaferro y colaboradores, publicaron un estudio de referencia con los resultados de más de 50 pacientes que fueron trasplantados por HCC. Se obtuvieron unos criterios pronósticos específicos, propuestos en 1996, que se conocen como los criterios de Milán. Aplicando estos criterios, con un tumor de HCC único menor de 5 cm o tres tumores de 3 cm como máximo, se demostró una tasa de supervivencia del 75% a los 4 años. En una reciente revisión de 90 estudios, controlando a 17.780 pacientes durante un período de 15 años, se identificaron los criterios de Milán como un factor pronóstico independiente de los resultados.
Los criterios publicados por la Universidad de California en San Francisco (UCSF), son más amplios, pero no se admiten en nuestro medio. Incluyen:
1) Una sola lesión igual o menor de 6,5 cm.
2) Tres o menos nódulos con la mayor lesión de menos de 4,5 cm y un diámetro total igual o menor a 8 cm. Estos criterios se han estudiado retrospectivamente y prospectivamente y han mostrado una supervivencia y recurrencia similar a la de los pacientes utilizando los criterios de Milán, con tasas de supervivencia del 90% y el 75% al año y a los 5 años, respectivamente. Los criterios de Milán y los de la UCSF consideran el número y el tamaño del tumor, independientemente de la biología del tumor.
La Universidad de Toronto desarrolló un protocolo para tumores grandes de hasta 10 cm, excluyendo los tumores pobremente diferenciados; además, los pacientes fueron tratados antes del trasplante con terapias ablativas, obtuvieron una supervivencia similar a la de los pacientes que cumplían los criterios de Milán. Dichos criterios tampoco se admiten en nuestro entorno, debido al elevado número de personas con HCC en lista de espera y a la relativa falta de donantes.
Las terapias locorregionales se utilizan para reducir el tamaño del HCC y para controlar su evolución. Recientemente se ha demostrado que este tratamiento en pacientes seleccionados mejora la supervivencia.
Una alternativa al trasplante de hígado de donante fallecido es el trasplante de un donante vivo. En los programas de trasplante de hígado de donante vivo, se ha publicado una mortalidad estimada del donante del 0,3% y la tasa de complicaciones del 2%. Debido a los riesgos conocidos para el donante, el trasplante hepático de donante vivo debe restringirse a centros muy especializados.
Tratamientos no quirúrgicos
- Quimioembolización Transarterial (QE) / Radiofrecuencia (RF)
El tratamiento inicial del HCC suele ser una terapia locorregional como la QE o la RF para reducir el tamaño tumoral e inhibir posibles micrometástasis. El hígado normal recibe sangre de la vena porta (en un 75%) y de la arteria hepática (en un 25%). A medida que el tumor aumenta de tamaño, el aporte de sangre de la arteria hepática va aumentando. Esta característica del tumor es la base de los criterios radiológicos específicos utilizados en el diagnóstico radiológico del HCC.
En la QE se realiza la embolización de la rama nutricia del tumor, procedente de la arteria hepática, con lo que se logra una reducción significativa del flujo de sangre arterial, con la consiguiente hipoxia tumoral selectiva y eventualmente necrosis del tumor. Además, se pueden administrar partículas de agentes terapéuticos en la infusión terapéutica: microesferas de almidón, agente quimioterápico y gelfoam utilizado para embolización. Históricamente, se utilizaron diversos fármacos quimioterápicos. Actualmente se aplica la doxorrubicina o la QE con partículas cargadas con quimioterápico, como alternativas más efectivas.
Las contraindicaciones para la práctica de una QE se centran en los pacientes con cirrosis descompensada (Child-Pugh B), si existe un desarrollo extenso del tumor con afectación de ambos lóbulos, una disminución grave del flujo portal (oclusión de la vena porta o con el flujo sanguíneo invertido, hepatofugal) y un aclaramiento de creatinina de menos de 30 mL/min. Llovet et al. comunicaron que, en los HCC no candidatos a operación, las probabilidades de supervivencia tras una QE fueron del 82% y del 63% al año y a los 2 años, respectivamente, y que la respuesta a la QE es un buen predictor de supervivencia. Otros estudios también han mostrado una mejoría en la supervivencia en pacientes tratados con QE, con un rango entre 20-60% a los 2 años. La tasa de complicaciones por la QE es relativamente baja, alrededor del 5%, los pacientes pueden presentar dolor abdominal, náuseas y fiebre.
- Radioterapia Transarterial
La radioembolización transarterial es una forma de radiación interna a través de un catéter dirigido que introduce microesferas con radioisótopos directamente en el tumor. Se administran microesferas de itrio-90 (Y-90) o con lipiodol marcados con yodo-131 en un procedimiento similar a la QE convencional. Este procedimiento ha demostrado ser seguro y eficaz en los pacientes cirróticos con HCC. Una ventaja del Y-90 sobre la QE es que ésta se podría indicar en el caso de trombosis neoplásica de la vena porta, mientras que ha sido considerada como una contraindicación para la QE.
Los efectos secundarios son generalmente bien tolerados. Los más comunes son fatiga, náuseas, vómitos y dolor abdominal, el llamado síndrome posembolización (fiebre, náuseas, malestar general, pérdida de apetito y dolor abdominal), pero es poco frecuente. Se precisa una evaluación pretratamiento mediante angiografía. La tasa informada de necrosis completa del HCC fue del 90% en pacientes con tumores de menos de 3 cm.
- Ablación Percutánea (tratamiento local)
La técnica de la ablación local percutánea incluye la Radiofrecuencia (RF) y la inyección percutánea de etanol. Constituye el tratamiento estándar en el HCC no candidato a cirugía de resección, en la clasificación BCLC en la etapa 0-A. La RF es un tratamiento de elección para la destrucción local de los tumores hepáticos y produce una necrosis coagulativa del tumor dejando un margen de seguridad alrededor del tumor; por ello es la terapia de ablación local más común. La RF se realiza por vía percutánea bajo guía radiológica con ecografía o bien durante la cirugía. La ablación completa de los tumores de menos de 2 cm es posible en más del 90% de los casos. Existen algunas limitaciones para la RF:
- En tumores de más de 3 cm, la necrosis completa se observa raramente.
- Es difícil la ablación de tumores adyacentes a vasos sanguíneos importantes.
- Es difícil llegar a ciertos segmentos del hígado por vía percutánea (en especial, al segmento 1).
- Las lesiones subcapsulares pueden romperse en el peritoneo.
- La vesícula biliar puede lesionarse por la ablación del segmento IVb.
- En hígados con cirrosis multinodular, la detección de varios nódulos por ecografía puede ser muy difícil.
La inyección del tumor con etanol requiere varias sesiones y debido a que la inyección de etanol raramente alcanza el volumen total del tumor se prefiere realizar una RF.
- Tratamiento sistémico (quimioterapia vía oral)
En el estudio presentado, el beneficio de supervivencia se mantuvo en los análisis realizados por subgrupos, según la región geográfica y según la etiología, y en todos se asoció a una mejor supervivencia libre de progresión y a un mejor control de la enfermedad. Dos pacientes tratados con regorafenib tuvieron una respuesta tumoral completa. La supervivencia del grupo placebo en este estudio es consistente con estudios previos de segunda línea en HCC.
Con el uso de cinco factores de estratificación en este estudio se aseguró que los grupos de ensayo estuviesen completamente equilibrados, teniendo en cuenta las características comúnmente evaluadas en los pacientes y por estadio de la enfermedad. También se analizó la distribución de pacientes entre los grupos de tratamiento de acuerdo con el patrón de progresión tumoral mientras recibían sorafenib. Recientemente, se ha encontrado que el patrón de progresión es un factor importante que afecta al resultado y puede confundir los resultados del estudio.
Todos los resultados de eficacia primaria y secundaria en esta población pretratada con sorafenib aparecen numéricamente mejores que los que resultan del tratamiento inicial con sorafenib. Esto puede ser debido a que el regorafenib es más activo desde el punto de vista farmacológico que el sorafenib. Asimismo, el regorafenib mejoró la tolerancia para los pacientes previamente tolerantes al sorafenib debido a que los eventos adversos de los dos fármacos se solapan. Como inhibidores de multicininasa, la actividad antitumoral de regorafenib y sorafenib podría extenderse más allá de sus propiedades antiangiogénicas a un efecto directo sobre las células tumorales y también estromales que modulan los procesos inflamatorios e inmunes asociados al tumor.
Los resultados de este estudio sugieren que el uso secuencial de dos inhibidores de multicininasas con perfiles parcialmente superpuestos proporcionan un beneficio de supervivencia en el HCC. Estos datos subrayan que la prolongación del tratamiento con los inhibidores de multicininasas, tales como la secuencia de sorafenib y regorafenib junto con el manejo adecuado de los eventos adversos, puede conducir a una extensión de la supervivencia. En conclusión, este estudio cumplió su criterio de valoración primario mostrando que regorafenib mejoraba la supervivencia global en pacientes con HCC que tuvieron progresión de la enfermedad durante el tratamiento de primera línea con sorafenib.
Regorafenib es un tratamiento sistémico que proporciona un beneficio de supervivencia en pacientes con HCC cuando el tumor progresa durante el tratamiento con sorafenib.
Recientemente, gracias al estudio CELESTIAL, se ha aprobado la administración de cabozantinib, inhibidor de tirosina quinasas como VEGFR 1-3, MET y AXL, como tratamiento de segunda línea.
En este estudio, cabozantinib ha mostrado al compararse con resultados con placebo una mejor supervivencia y un mejor resultado en cuanto a tiempo libre de progresión del tumor.
Otro tratamiento de segunda línea aprobado gracias al estudio REACH 2, para pacientes con HCC previamente tratado, que siguen con una hepatopatía compensada y con elevación importante de alfa-fetoproteína, es el ramucirumab, anticuerpo monoclonal anti-VEGFR2,
Lenvatinib es otro tratamiento oncológico inhibidor de quinasas como son VEGFR1, VEGFR2 y VEGFR3 y eficaz en otros cánceres. Se ha estudiado en el HCC irresecable, demostrando que su eficacia no es inferior a los resultados con sorafenib, por lo que también estaría indicado en un tratamiento de segunda línea.
Las fichas técnicas de estos tratamientos inhibidores de tirosina quinasas y basados en anticuerpos monoclonales, advierten de riesgos bien conocidos, pues pueden causar toxicidad dermatológica, problemas digestivos graves, hipertensión y un mayor riesgo de hemorragias.
Las terapias inmunes de administración sistémica han demostrado su eficacia en el HCC. Los más estudiados son: nivolumab y pembrolizumab para pacientes en los que ha fallado el sorafenib.
Según la Guía de Práctica Clínica de la EASL (European Association for the Study of the Liver): “En base de datos no controlados pero prometedores, la terapia inmune con nivolumab ha recibido la aprobación de la FDA en el tratamiento de segunda línea, y se esperan más resultados de estudios de Fase 3 para la aprobación convencional. En la actualidad, los datos no son lo suficientemente maduros como para dar una recomendación clara”.
Resumen y conclusiones
La incidencia del HCC está aumentando más rápido que cualquier otro cáncer, con un aumento de las tasas de mortalidad en un 3% por año desde el año 2000. En 2019, el HCC será la quinta y la séptima causa principal de muerte por cáncer en hombres y mujeres, respectivamente. Un elevado número de casos presentarán una enfermedad irresecable, y van a requerir terapia sistémica para el control de la enfermedad. El inhibidor multicinasa oral sorafenib fue aprobado por la FDA en 2007 para pacientes con HCC avanzado; y fue la única terapia aprobada por la FDA para esta indicación durante una década.
Desde 2017 se han aprobado otros cinco tratamientos para el HCC. La estrategia óptima para seleccionar y administrar los tratamientos de forma secuencial se siguen estudiando. Los temas en los que más se trabaja, aparte de la eficacia de los fármacos, son sus perfiles de seguridad y los posibles biomarcadores pronósticos de su eficacia, que serían básicos para la selección de agentes.
Dadas las diversas opciones para tratar en 2019 el HCC avanzado, es crucial la diferenciación de los posibles efectos adversos y los predictores de resultados terapéuticos para ayudar a determinar el beneficio potencial o la falta del mismo de una manera más segura.
El perfil de los efectos adversos de cada tratamiento es importante para seleccionar el más indicado en cada caso, porque el 31% de los pacientes recién diagnosticados con HCC avanzado tienen hipertensión arterial, aproximadamente el 10% tienen cardiopatía, el 15% serían diabéticos y el 11% tendría enfermedad pulmonar crónica. Estas comorbilidades podrían verse exacerbadas por toxicidades relacionadas con el tratamiento.
Además, el HCC tiene un impacto notable en la calidad de vida: afecta a la capacidad de trabajo, reduce los niveles de energía y empeora el estado de ánimo, en mayor medida de lo que sienten los pacientes con enfermedad hepática crónica, siendo el impacto mayor su percepción de aumento de la fatiga y falta de concentración. Aquellos con enfermedad más avanzada y peor función hepática presentan más síntomas como son: dolor, sueño, fatiga, falta de apetito, pérdida de peso, etc. En resumen, tienen una menor calidad de vida relacionada con la salud.
La terapia sistémica tiene un impacto en la calidad de vida por los síntomas asociados a la toxicidad de la piel y a la fatiga, que son dos efectos adversos frecuentes de los tratamientos. El 60% de los pacientes siente que los efectos adversos afectaron a su capacidad para trabajar, y el 37% dice que el tratamiento disminuyó su capacidad para realizar actividades de la vida diaria. Se ha visto que la calidad de vida antes del tratamiento también es un factor pronóstico de supervivencia en pacientes con HCC.
Los niveles más altos de fatiga, diarrea y pérdida de apetito se correlacionan con una menor supervivencia, mientras que una mejor función física y mayor capacidad para participar en actividades sociales y de otro tipo se asocian con una mayor supervivencia.
Debido a que la calidad de vida puede ayudar a predecir la supervivencia, y a que las toxicidades relacionadas con el tratamiento pueden afectar en gran medida la calidad de vida, elegir la secuencia óptima de tratamientos para un paciente individual puede beneficiar no sólo la supervivencia, sino también la calidad de vida y los aspectos físicos de la misma. Hasta la fecha, no se han validado marcadores predictivos biológicos o clínicos de supervivencia o toxicidad. Además, la mayoría de los datos retrospectivos se han obtenido de pacientes tratados con sorafenib. Existen pocos datos sobre pacientes tratados con otros inhibidores multiquinasas, anticuerpos anti-receptor de VEGF o tratamientos inmunológicos. Aunque se necesitan más estudios en esta área, algunos datos sugieren candidatos potenciales como predictores clínicos.
Referencias:
- Forner A, Reig M, Varela M,et al. Diagnosis and treatment of hepatocellular carcinoma. Update consensus document from the AEEH, SEOM, SERAM, SERVEI and SETH. Med Clin (Barc). 2016;146(11):511.e1-511.e22.
- Walker M, El-Serag HB, Sada Y, et al. Cirrhosis is under-recognised in patients subsequently diagnosed with hepatocellular cancer. Aliment Pharmacol Ther 2016;43: 621-630.
- Bruix J, Reig M, Sherman M. Evidence-Based Diagnosis, Staging, and Treatment of Patients with Hepatocellular Carcinoma. Gastroenterology 2016;150:835-853.
- Villanueva A. Hepatocellular Carcinoma. N Engl J Med 2019;380:1450-1462.
- Farazi PA, DePinho RA. Hepatocellular carcinoma pathogenesis: from genes to environment, Nat Rev Cancer. 2006;6:674-687.
- Akinyemiju T, Abera S, Ahmed M et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level: Results From the Global Burden of Disease Study 2015. JAMA Oncol 2017;3:1683–1691.
- Balogh J, Victor V III, Asham E H.et al. Hepatocellular carcinoma: a review. Journal of Hepatocellular Carcinoma 2016:3 41–53.
- Marrero JA, Kulik LM, Sirlin CB et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the AASLD. Hepatology 2018; 68: 723-750.
- Erickson LA. Hepatocellular Carcinoma. Mayo Clin Proc 2017;92(8):1321-1322.
- Shindoh J, Makuuchi M, Matsuyama Y et al. Complete removal of the tumor-bearing portal territory decreases local tumor recurrence and improves disease-specific survival of patients with hepatocellular carcinoma. J Hepatol 2016; 65:1062–1063.
- Tran SA, Le A, Zhao C, Hoang J et al. Rate of hepatocellular carcinoma surveillance remains low for a large, real-life cohort of patients with hepatitis C cirrhosis BMJ Open Gastro 2018; 5: e000192. doi:10.1136/bmjgast-2017-000192.
- Serper M1, Taddei TH2, Mehta R et al. Association of Provider Specialty and Multidisciplinary Care with Hepatocellular Carcinoma Treatment and Mortality. Gastroenterology. 2017; 152: 1954-1964.
- Ronot M, Purcell Y, Vilgrain V. Hepatocellular Carcinoma: Current Imaging Modalities for Diagnosis and Prognosis. Digestive Diseases and Sciences 2019; 64:934–950.
- Vogl TJ, Gruber-Rouh T.HCC: Transarterial Therapies—What the Interventional Radiologist Can Offer. Digestive Diseases and Sciences 2019; 64:959–967.
- Bailey CW, Sydnor Jr.MK. Current State of Tumor Ablation Therapies. Digestive Diseases and Sciences 2019; 64:951–958.
- Krishnamoorthy SK, Relias V, Sebastian S et al. Management of regorafenib-related toxicities: a review. Therap Adv Gastroenterol. 2015; 8:285-297.
- EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol2018; 69:182-236.
- Wörns M, Galle P. Patient prioritisation in HCC treatment: All (good) things come in threes J Hepatol 2018;68: 1311 -1312.
- Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet 2018; 391 1301-1314.
Info de contacto
Pere Vergés 1, piso 10, desp 12, Hotel d’Entitats La Pau, 08020 - Barcelona
L-J de 09:00-13:30h.
933 145 209 - 615 052 266
