Recomendaciones de la EASL sobre el tratamiento de la hepatitis C en 2018
La infección por el virus de la hepatitis C (VHC) es una causa importante de enfermedad hepática crónica, con aproximadamente 71 millones de personas con infección crónica en todo el mundo.
La atención clínica para pacientes con enfermedad hepática relacionada con el VHC ha avanzado considerablemente gracias a una mejor comprensión de la fisiopatología de la enfermedad y al desarrollo de procedimientos de diagnóstico y mejoras en la terapia y la prevención. Estas recomendaciones de la EASL (European Association for the Study of the Liver) para el tratamiento de la hepatitis C describen el manejo óptimo de los pacientes con infecciones agudas y crónicas por VHC en 2018 y en adelante.
La infección por el virus de la hepatitis C (VHC) es una de las principales causas de enfermedad hepática crónica en todo el mundo. La historia natural a largo plazo de la infección por VHC es muy variable. La lesión hepática puede variar desde cambios histológicos mínimos hasta fibrosis extensa y cirrosis con o sin carcinoma hepatocelular (CHC). Hay aproximadamente 71 millones de personas con infección crónica en todo el mundo, muchas de las cuales desconocen su infección, con variaciones importantes según el área geográfica. La atención clínica para pacientes con enfermedad hepática relacionada con el VHC ha avanzado considerablemente durante las últimas dos décadas, gracias a una mejor comprensión de la fisiopatología de la enfermedad, y debido a los avances en los procedimientos de diagnóstico y las mejoras en la terapia y la prevención.
El objetivo principal de la terapia contra el VHC es curar la infección, es decir, lograr una respuesta virológica sostenida (RVS) definida como ARN del VHC no detectable 12 semanas (RVS12) o 24 semanas (RVS24) después de completar el tratamiento. Una RVS corresponde a una cura de la infección por el VHC, con una probabilidad muy baja de recaída tardía. Una RVS se asocia generalmente con la normalización de las enzimas hepáticas y la mejora o desaparición de la necroinflamación y fibrosis hepática en pacientes sin cirrosis. Los pacientes con fibrosis avanzada (puntuación METAVIR F3) o cirrosis (F4) continúan en riesgo de complicaciones potencialmente mortales. Sin embargo, la fibrosis hepática puede retroceder y el riesgo de complicaciones como insuficiencia hepática e hipertensión portal se reduce después de una RVS.
Los datos recientes sugieren que el riesgo de CHC y la mortalidad relacionada con el hígado se reduce significativamente, pero no se elimina, en pacientes con cirrosis que eliminan el VHC en comparación con los pacientes no tratados y los respondedores virológicos no sostenidos, especialmente en presencia de cofactores de la morbilidad hepática, como el síndrome metabólico, el consumo nocivo de alcohol y/o la infección concurrente por el virus de la hepatitis B (VHB). El VHC también está asociado con una serie de manifestaciones extrahepáticas y la eliminación viral induce la reversión de la mayoría de ellas con una reducción de todas las causas de mortalidad.
Estas recomendaciones de la EASL sobre el tratamiento de la hepatitis C están destinadas a ayudar a los médicos y otros proveedores de atención médica, así como a los pacientes y otras personas interesadas, en el proceso de toma de decisiones clínicas, describiendo el tratamiento óptimo actual de los pacientes con VHC agudo y crónico. Estas recomendaciones se aplican a las terapias que han sido aprobadas por la Agencia Europea de Medicamentos (EMA, en sus siglas en inglés) y otras agencias nacionales europeas en el momento de su publicación.
Diagnóstico de la hepatitis C aguda y crónica
Recomendaciones
- Todos los pacientes con sospecha de infección por VHC deben someterse a una prueba de detección de anticuerpos anti-VHC en suero o plasma como prueba diagnóstica de primera línea.
- En el caso de sospecha de hepatitis C aguda, en pacientes inmunocomprometidos y en pacientes en hemodiálisis, las pruebas de ARN del VHC en suero o plasma deben formar parte de la evaluación inicial.
- Si se detectan anticuerpos anti-VHC, el ARN del VHC debe determinarse mediante un método molecular sensible con un límite de detección inferior ≤15 UI/ml.
- En los países de ingresos bajos y medios, y en los ajustes específicos en los países de ingresos altos, se puede utilizar un análisis de ARN del VHC cualitativo con un límite de detección inferior ≤1000 UI/ml (3,0 Log10 UI/ml) para proporcionar acceso asequible al diagnóstico y atención del VHC.
- Los anticuerpos anti-VHC positivos y los individuos negativos para el ARN del VHC deben volver a analizarse para el ARN del VHC 12 y 24 semanas después para confirmar el aclaramiento definitivo.
- El antígeno central del VHC en suero o plasma es un marcador de la replicación del VHC que se puede usar en lugar del ARN del VHC para diagnosticar una infección crónica del VHC cuando los ensayos de ARN del VHC no están disponibles o no son asequibles.
Detección / screening de la hepatitis C crónica
Recomendaciones
- Las estrategias de detección de la infección por VHC deben definirse de acuerdo con la epidemiología local de la infección por VHC, idealmente en el marco de los planes nacionales.
- Las estrategias de detección de la infección por el VHC pueden incluir la detección de poblaciones con riesgo de infección, pruebas de cohorte de nacimiento y pruebas de la población general en áreas de seroprevalencia intermedia a alta (≥2%-5%).
- La detección de la infección por VHC debe basarse en la detección de anticuerpos anti-VHC en suero o plasma mediante un inmunoensayo enzimático.
- La detección de anticuerpos anti-VHC debe ofrecerse en relación con la prevención, la atención y el tratamiento.
- Se puede usar sangre entera obtenida de muestras de sangre seca como alternativa al suero o plasma obtenido por venopunción para pruebas de anticuerpos anti-VHC, después del envío a un laboratorio central donde se realizará el inmunoensayo enzimático.
- Las RDT que utilizan suero, plasma, punción digital o fluido crevicular (saliva) como matrices pueden usarse en lugar de los inmunoensayos enzimáticos clásicos en el sitio de atención del paciente para facilitar la detección de anticuerpos contra el VHC y mejorar el acceso a la atención.
- Si se detectan anticuerpos anti-VHC, se debe determinar la presencia de ARN del VHC o, como alternativa, el antígeno central del VHC (si los ensayos de ARN del VHC no están disponibles y/o no son asequibles) en suero o plasma para identificar a los pacientes con infección en curso.
- Se puede usar sangre entera extraída de muestras de sangre seca como alternativa al suero o plasma obtenido por venopunción para la prueba de ARN del VHC, después del envío a un laboratorio central donde se realizará la prueba molecular.
- Las pruebas de reflejo para el ARN del VHC en pacientes con anticuerpos anti-VHC positivos deben aplicarse para aumentar el vínculo con la atención.
- El examen de detección de anticuerpos anti-VHC para detectar la infección por VHC se puede reemplazar por un análisis de ARN del VHC en el punto de atención con un límite de detección inferior ≤1000 UI/ml (3,0 Log10 UI/ml) o pruebas de antígeno central del VHC, si dichos análisis están disponibles y la estrategia de cribado demuestra ser rentable.
Objetivos y criterios de valoración del tratamiento del VHC
Recomendaciones
- El objetivo de la terapia es curar la infección por VHC para: (i) prevenir las complicaciones hepáticas y extrahepáticas relacionadas con el VHC, incluida la necroinflamación hepática, la fibrosis, la cirrosis, la descompensación de la cirrosis, el CHC, la enfermedad grave, las manifestaciones hepáticas y la muerte; (ii) mejorar la calidad de vida y eliminar el estigma; y (iii) evitar la transmisión del VHC.
- El punto final de la terapia es el ARN del VHC no detectable en suero o plasma mediante un ensayo sensible (límite inferior de detección ≤15 UI/ml) 12 semanas (RVS12) o 24 semanas (RVS24) después del final del tratamiento.
- El antígeno central del VHC no detectable en suero o plasma 24 semanas (RVS24) después del final del tratamiento se puede usar como un punto final alternativo de la terapia en pacientes con antígeno del núcleo del VHC detectable antes de la terapia, si los análisis de ARN del VHC no están disponibles o no son asequibles.
- Se puede utilizar un ARN del VHC no detectable en suero o plasma 24 semanas (RVS24) después del final del tratamiento, utilizando un análisis de ARN del VHC cualitativo con un límite de detección inferior ≤1000 UI/ml (3,0 Log10 UI/ml), como un punto final alternativo de la terapia en áreas donde los análisis de ARN del VHC sensibles no están disponibles y/o no son asequibles.
- En pacientes con fibrosis avanzada y cirrosis, la vigilancia de CHC debe continuarse porque una RVS reducirá, pero no eliminará, el riesgo de CHC.
Evaluación preterapéutica
Se debe evaluar la gravedad de la enfermedad hepática y se deben determinar los parámetros virológicos de referencia que serán útiles para la terapia de adaptación.
Recomendaciones
- La contribución de las comorbilidades a la progresión de la enfermedad hepática deben evaluarse e implementarse las medidas correctivas apropiadas.
- La gravedad de la enfermedad hepática debe evaluarse antes de la terapia.
- Se debe identificar a los pacientes con cirrosis, ya que su régimen de tratamiento debe ajustarse y la vigilancia posterior al tratamiento para el CHC es obligatoria.
- La vigilancia posterior al tratamiento para el CHC también debe realizarse en pacientes con fibrosis avanzada (puntuación METAVIR F3).
- La etapa de fibrosis debe evaluarse mediante métodos no invasivos inicialmente, con biopsia de hígado reservada para casos en los que existe incertidumbre o posibles etiologías adicionales.
- La función renal (creatinina/tasa de filtración glomerular estimada [eGFR]) debe determinarse.
- Las manifestaciones extrahepáticas de la infección por VHC deben identificarse en caso de síntomas.
- Se debe proponer la vacunación contra el VHB y el VHA a los pacientes que no están protegidos.
ARN del VHC o detección/cuantificación del antígeno central del VHC
Recomendaciones
- La detección y cuantificación del ARN del VHC en suero o plasma se debe realizar mediante un ensayo sensible con un límite inferior de detección de ≤15 UI/ml.
- En los países de ingresos bajos y medios y en los ajustes específicos en los países de ingresos altos, se puede utilizar un análisis de ARN del VHC cualitativo con un límite inferior de detección de ≤1000 UI/ml si no se dispone de ensayos cuantitativos más sensibles y/o no asequibles.
- Si la prueba de ARN del VHC no está disponible y/o no es asequible, la detección y cuantificación del antígeno central del VHC por EIA se puede usar como un marcador sustituto de la replicación del VHC.
- El genotipo del VHC y el subtipo del genotipo 1 (1a o 1b) deben evaluarse antes del inicio del tratamiento para determinar la elección del tratamiento y su duración, entre otros parámetros.
- El tratamiento con nuevos regímenes pangenotípicos puede iniciarse sin conocimiento del genotipo y subtipo en áreas donde la determinación del genotipo no está disponible y/o no es asequible, o para simplificar el acceso al tratamiento.
- Las pruebas de resistencia al VHC antes del tratamiento no se recomiendan.
- En áreas donde sólo se dispone de regímenes que requieren optimización basada en pruebas de resistencia antes del tratamiento, y los médicos tienen fácil acceso a una prueba confiable que evalúa la resistencia del VHC a los inhibidores de NS5A (que abarcan los aminoácidos 24 a 93), estos análisis pueden guiar las decisiones, como se especifica en las Recomendaciones EASL para el tratamiento de la hepatitis C 2016.
Contraindicaciones a la terapia
Recomendaciones
- El uso de ciertos agentes inductores del citocromo P450 (CYP) / P-glicoproteína (P-gp) (como carbamazepina y fenitoína) está contraindicado con todos los regímenes, debido al riesgo de concentraciones significativamente reducidas de AADs.
- Los regímenes de tratamiento que comprenden un inhibidor de la proteasa no deben usarse en pacientes con cirrosis descompensada con Child-Pugh B o C o en pacientes con episodios previos de descompensación.
- En pacientes con un eGFR <30 ml/min/1,73 m2, sofosbuvir sólo debe usarse si no existe un tratamiento alternativo aprobado para su uso en pacientes con insuficiencia renal grave.
Indicaciones para el tratamiento: ¿quién debe ser tratado?
Recomendaciones
- Todos los pacientes con infección por VHC deben considerarse para el tratamiento, incluidos los pacientes sin tratamiento previo y los individuos que no lograron la RVS después del tratamiento previo.
- El tratamiento debe considerarse sin demora en pacientes con fibrosis significativa o cirrosis (puntuación METAVIR F2, F3 o F4), incluida la cirrosis compensada (Child-Pugh A) y descompensada (Child-Pugh B o C), en pacientes con enfermedad clínicamente significativa. Manifestaciones hepáticas (por ejemplo, vasculitis sintomática asociada con crioglobulinemia mixta relacionada con el VHC, nefropatía relacionada con el complejo inmune del VHC y linfoma no Hodgkin de células B), en pacientes con recidiva del VHC después del trasplante de hígado, en pacientes con riesgo de una rápida evolución de enfermedad hepática debido a comorbilidades concurrentes (receptores de trasplantes de órganos o células madre no hepáticos, coinfección por VHB, diabetes) y en individuos con riesgo de transmisión de VHC (PQID, hombres que tienen relaciones sexuales con hombres con prácticas sexuales de alto riesgo, mujeres en edad fértil que deseen quedarse embarazadas, pacientes en hemodiálisis, individuos encarcelados).
- Los pacientes con cirrosis descompensada (Child-Pugh B o C) y una indicación de trasplante hepático con una puntuación MELD ≥18-20 deben ser trasplantados primero y tratados después del trasplante.
- Si el tiempo de espera en una lista de trasplante de hígado es de más de 6 meses, los pacientes con cirrosis descompensada (Child-Pugh B o C) con una puntuación MELD ≥18-20 pueden ser tratados antes del trasplante, aunque el beneficio clínico para estos pacientes no es bien establecido.
- En general, no se recomienda el tratamiento en pacientes con una esperanza de vida limitada debido a comorbilidades no relacionadas con el hígado.
Medicamentos disponibles en Europa en 2018
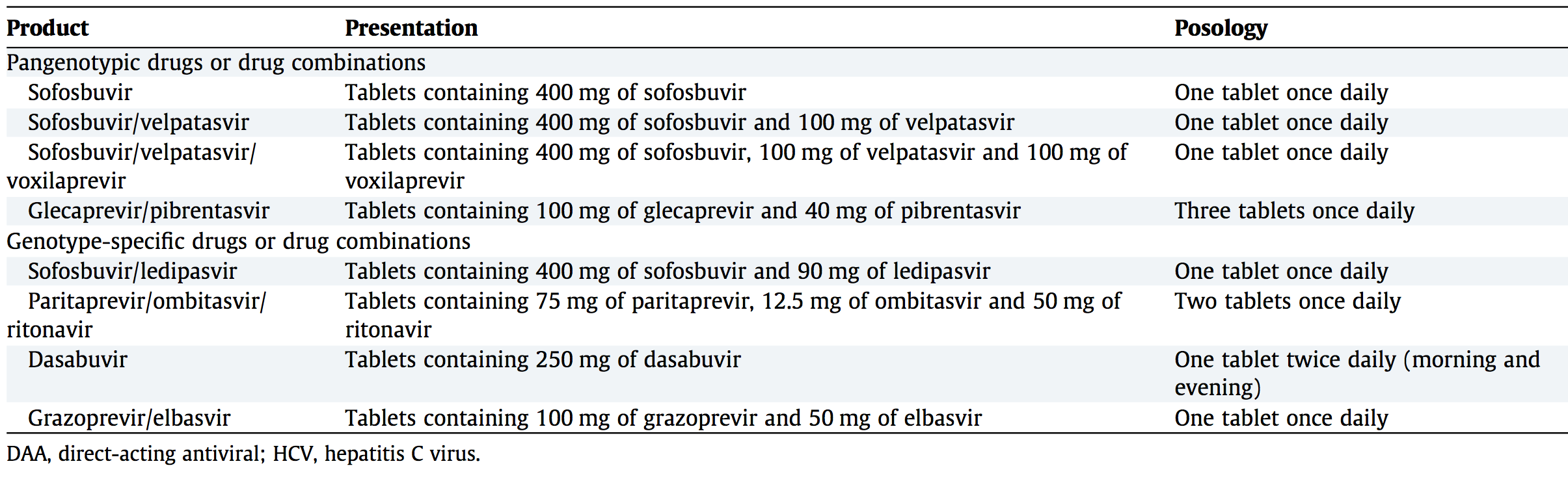
Recomendaciones
- Las interacciones farmacológicas numerosas y complejas son posibles con los AAD del VHC. Por lo tanto, se requiere una evaluación exhaustiva del riesgo de interacción farmacológica antes de comenzar el tratamiento y antes de comenzar otros medicamentos durante el tratamiento en todos los pacientes que reciben tratamiento con AADs, según la información de prescripción para cada AAD (un recurso clave de Internet es hep-druginteractions.org donde las recomendaciones se actualizan periódicamente).
- Las interacciones entre medicamentos son una consideración clave en el tratamiento de pacientes coinfectados con VIH-VHC, y se debe prestar mucha atención a los medicamentos contra el VIH que están contraindicados, no se recomiendan o requieren un ajuste de la dosis con regímenes de AADs específicos.
- Se debe educar a los pacientes sobre la importancia de la adhesión a la terapia, siguiendo las recomendaciones de dosificación e informando el uso de otros medicamentos recetados, medicamentos de venta libre, medicamentos comprados a través de Internet y el uso de drogas de fiesta o recreativas.
Tratamiento de la hepatitis C crónica, incluidos los pacientes sin cirrosis y los pacientes con cirrosis compensada (Child-Pugh A)
Recomendaciones
- Los regímenes sin IFN, sin ribavirina y basados en AADs deben usarse en pacientes infectados por el VHC sin cirrosis o con cirrosis compensada (Child-Pugh A), incluidos los pacientes “sin tratamiento previo” (definidos como pacientes nunca tratados por su infección por el VHC) y pacientes “con experiencia en el tratamiento” (definidos como pacientes que fueron tratados previamente con IFN-a pegilado y ribvirina; o IFN-a pegilado, ribavirina y sofosbuvir; o sofosbuvir y ribavirina), debido a su eficacia virológica, facilidad de uso, seguridad y tolerabilidad.
- Los mismos regímenes de tratamiento sin IFN y sin ribavirina deben usarse en pacientes coinfectados con VIH como en pacientes sin infección por VIH, ya que los resultados virológicos de la terapia son idénticos. Las alteraciones del tratamiento o los ajustes de la dosis deben realizarse en caso de interacciones con medicamentos antirretrovirales.
- Siempre que sea posible (la misma duración del tratamiento, tasas de RVS equivalentes), se prefieren los regímenes combinados que comprenden dos medicamentos para triplicar los regímenes combinados, a fin de minimizar el riesgo de efectos secundarios e interacciones medicamentosas.
Tratamiento de la infección por el genotipo 1a del VHC
Recomendaciones
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con el genotipo 1a, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola tableta administrada una vez al día.
- La combinación de dosis fija de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres tabletas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
- La combinación de dosis fija de sofosbuvir (400 mg) y ledipasvir (90 mg) en una sola tableta administrada una vez al día.
- La combinación de dosis fija de grazoprevir (100 mg) y elbasvir (50 mg) en una sola tableta administrada una vez al día).
Genotipo 1a, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 1a del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fijas de sofosbuvir y velpatasvir durante 12 semanas.
Genotipo 1a, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 1a del VHC sin cirrosis deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 1a del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
Genotipo 1a, Genotipo específico: Sofosbuvir / ledipasvir
- Los pacientes sin tratamiento previo infectados con el genotipo 1a del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir durante 12 semanas.
- Los pacientes sin tratamiento previo infectados con el genotipo 1a del VHC sin cirrosis pueden tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir durante 8 semanas.
- La combinación de sofosbuvir y ledipasvir no se recomienda en pacientes con experiencia en el tratamiento infectados con el genotipo 1a.
Genotipo 1a, Genotipo específico: Grazoprevir / elbasvir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con genotipo 1a, sin cirrosis o con cirrosis compensada (Child-Pugh A), con un nivel de ARN del VHC ≤800.000 UI/ml (5,9 Log10 UI/ml) al inicio del tratamiento deben tratarse con combinación de dosis fija de grazoprevir y elbasvir durante 12 semanas.
- La combinación de grazoprevir y elbasvir no se recomienda en pacientes infectados con el genotipo 1a con un nivel de ARN del VHC> 800.000 UI/ml (5,9 Log10 UI/ml).
Tratamiento de la infección por el genotipo 1b del VHC
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con el genotipo 1b, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fija de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres pastillas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
- La combinación de dosis fija de sofosbuvir (400 mg) y ledipasvir (90 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fija de grazoprevir (100 mg) y elbasvir (50 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fijas de ombitasvir (12,5 mg), paritaprevir (75 mg) y ritonavir (50 mg) en una sola tableta (dos pastillas una vez al día con alimentos) y dasabuvir (250 mg) (una pastilla dos veces al día).
Genotipo 1b, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 1b, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fijas de sofosbuvir y velpatasvir durante 12 semanas.
Genotipo 1b, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 1b sin cirrosis deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 1b con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
Genotipo 1b, Genotipo específico: Sofosbuvir / ledipasvir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 1b, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir durante 12 semanas.
- Los pacientes sin tratamiento previo infectados con el genotipo 1b sin cirrosis pueden tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir durante 8 semanas.
Genotipo 1b, Genotipo específico: Grazoprevir / elbasvir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con genotipo 1b, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de grazoprevir y elbasvir durante 12 semanas.
- Los pacientes sin tratamiento previo infectados con el genotipo 1b con fibrosis F0-F2 se pueden tratar con la combinación de dosis fija de grazoprevir y elbasvir durante 8 semanas.
Genotipo 1b, Genotipo específico: paritaprevir potenciado con ritonavir, ombitasvir y dasabuvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con genotipo 1b, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de ombitasvir, paritaprevir y ritonavir más dasabuvir durante 12 semanas.
- Los pacientes sin tratamiento previo infectados con el genotipo 1b con fibrosis F0-F2 pueden tratarse con la combinación de ombitasvir, paritaprevir y ritonavir más dasabuvir durante 8 semanas.
Tratamiento de la infección por el genotipo 2 del VHC
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con genotipo 2, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fijas de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres pastillas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
Genotipo 2, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 2 del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y velpatasvir durante 12 semanas.
Genotipo 2, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 2 del VHC sin cirrosis deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 2 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
Tratamiento de la infección por genotipo 3 del VHC
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con genotipo 3, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fija de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres pastillas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
- La combinación de dosis fija de sofosbuvir (400 mg), velpatasvir (100 mg) y voxilaprevir (100 mg) en una sola pastilla administrada una vez al día con alimentos.
Genotipo 3, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 3 del VHC sin cirrosis deben tratarse con la combinación de dosis fija de sofosbuvir y velpatasvir durante 12 semanas.
- La combinación de sofosbuvir y velpatasvir no se recomienda en pacientes sin tratamiento ni experimentados en el tratamiento infectados con el genotipo 3 del VHC con cirrosis compensada (Child-Pugh A), ya que se han informado resultados subóptimos con esta combinación.
Genotipo 3, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo infectados con el genotipo 3 del VHC, sin fibrosis moderada (puntuación METAVIR F0-F2), deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo infectados con el genotipo 3 del VHC, con fibrosis avanzada (puntuación METAVIR F3), pero sin cirrosis, pueden tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes con experiencia en el tratamiento infectados con el genotipo 3 del VHC sin cirrosis deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
- Los pacientes sin tratamiento previo infectados con el genotipo 3 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
- Los pacientes con experiencia en el tratamiento infectados con el genotipo 3 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 16 semanas.
Genotipo 3, Pangenotípico: Sofosbuvir / velpatasvir / voxilaprevir
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 3 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de sofosbuvir, velpatasvir y voxilaprevir durante 12 semanas.
Tratamiento de la infección por el genotipo 4 del VHC
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con genotipo 4, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fija de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres pastillas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
- La combinación de dosis fija de sofosbuvir (400 mg) y ledipasvir (90 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fija de grazoprevir (100 mg) y elbasvir (50 mg) en una sola pastilla administrada una vez al día.
Genotipo 4, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 4 del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y velopasvir durante 12 semanas.
Genotipo 4, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 4 del VHC sin cirrosis deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 4 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fijas de glecaprevir y pibrentasvir durante 12 semanas.
Genotipo 4, Genotipo específico: Sofosbuvir / ledipasvir
- Los pacientes sin tratamiento previo infectados con el genotipo 4 del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fijas de sofosbuvir y ledipasvir durante 12 semanas.
- La combinación de sofosbuvir y ledipasvir no se recomienda en pacientes con experiencia de tratamiento infectados con genotipo 4.
Genotipo 4, Genotipo específico: Grazoprevir / elbasvir
- Los pacientes sin tratamiento previo infectados con genotipo 4, sin cirrosis o con cirrosis compensada (Child-Pugh A), con un nivel de ARN del VHC ≤800,000 UI/ml (5,9 Log10 UI/ml) al inicio del tratamiento deben tratarse con la combinación de dosis fija de grazoprevir y elbasvir durante 12 semanas.
- La combinación de grazoprevir y elbasvir no se recomienda en pacientes infectados con genotipo 4 que no hayan recibido tratamiento con un nivel de ARN del VHC> 800,000 UI/ml (5,9 Log10 UI/ml), o experimentados por el tratamiento, independientemente de su nivel basal de ARN del VHC.
Tratamiento de la infección por el genotipo 5 del VHC
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con genotipo 5, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola pastilla administrada una vez al día.
- La combinación de dosis fija de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres pastillas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
- La combinación de dosis fijas de sofosbuvir (400 mg) y ledipasvir (90 mg) en una sola pastilla administrada una vez al día.
Genotipo 5, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 5 del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y velopasvir durante 12 semanas.
Genotipo 5, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 5 del VHC sin cirrosis deben tratarse con la combinación de dosis fijas de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 5 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
Genotipo 5, Genotipo específico: Sofosbuvir / ledipasvir
- Los pacientes sin tratamiento previo infectados con el genotipo 5 del VHC sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de sofosbuvir y ledipasvir durante 12 semanas.
- La combinación de sofosbuvir y ledipasvir no se recomienda en pacientes con experiencia de tratamiento infectados con genotipo 5.
Tratamiento de la infección por el genotipo 6 del VHC
- Se recomiendan los siguientes regímenes para el tratamiento de pacientes infectados con genotipo 6, de acuerdo con las siguientes recomendaciones:
- La combinación de dosis fija de sofosbuvir (400 mg) y velpatasvir (100 mg) en una sola tableta administrada una vez al día.
- La combinación de dosis fija de glecaprevir (300 mg) y pibrentasvir (120 mg) en tres tabletas que contienen 100 mg de glecaprevir y 40 mg de pibrentasvir, administradas una vez al día con alimentos.
- La combinación de dosis fijas de sofosbuvir (400 mg) y ledipasvir (90 mg) en una sola tableta administrada una vez al día.
Genotipo 6, Pangenotípico: Sofosbuvir / velpatasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 6 del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fijas de sofosbuvir y velpastasvir durante 12 semanas.
Genotipo 6, Pangenotípico: Glecaprevir / pibrentasvir
- Los pacientes sin tratamiento previo y los pacientes con experiencia en el tratamiento infectados con el genotipo 6 del VHC sin cirrosis deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 semanas.
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento infectados con el genotipo 6 del VHC con cirrosis compensada (Child-Pugh A) deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas.
Genotipo 6, Genotipo específico: Sofosbuvir / ledipasvir
- Los pacientes sin tratamiento previo infectados con VHC genotipo 6, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de sofosbuvir y ledipasvir durante 12 semanas.
- La combinación de sofosbuvir y ledipasvir no se recomienda en pacientes con experiencia en el tratamiento infectados con genotipo 6.
Tratamiento simplificado de la hepatitis C crónica con regímenes de fármacos pangenotípicos en pacientes sin cirrosis y en pacientes con cirrosis compensada (Child-Pugh A)
Recomendaciones
- Ahora es posible realizar recomendaciones simplificadas y pangenotípicas para el tratamiento anti-VHC, gracias a la aprobación de regímenes de medicamentos pangenotípicos anti-VHC altamente eficaces, seguros y bien tolerados.
- La evaluación previa al tratamiento puede limitarse a la prueba de la replicación del VHC (presencia de ARN del VHC o del antígeno central del VHC en suero o plasma) y la evaluación de la presencia o ausencia de cirrosis por medio de un marcador simple no invasivo (como FIB-4 o APRI) que determina si el paciente necesita un seguimiento posterior al tratamiento.
- Los pacientes sin tratamiento previo y con experiencia en el tratamiento sin cirrosis o con cirrosis compensada (Child-Pugh A) pueden tratarse con la combinación de dosis fija de sofosbuvir y velpatasvir durante 12 semanas, o la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas sin probar el genotipo.
- Si la cirrosis se puede excluir de manera confiable mediante un marcador no invasivo en pacientes sin tratamiento previo, la combinación de glecaprevir y pibrentasvir se puede administrar sólo durante 8 semanas.
- Se pueden usar medicamentos genéricos, siempre que el proveedor cumpla y garantice los controles de calidad.
- Las posibles interacciones farmacológicas deben comprobarse cuidadosamente y deben implementarse modificaciones de dosis cuando sea necesario.
- Dadas las altas tasas de RVS12 esperadas con estos regímenes en todos los grupos de pacientes si son adherentes, el control de la RVS12 12 semanas después del final del tratamiento es prescindible.
- Los pacientes con conductas de alto riesgo y riesgo de reinfección deben someterse a una prueba de RVS12 y, posteriormente, anualmente, siempre que sea posible.
- En pacientes con fibrosis avanzada (F3) o cirrosis compensada (F4), se debe proporcionar vigilancia post-RVS para el diagnóstico de CHC y vinculación con la atención cuando el tratamiento para CHC esté disponible.
Tratamiento de pacientes con enfermedad hepática grave con o sin una indicación de trasplante de hígado y pacientes en el entorno postrasplante de hígado
Recomendaciones
- Los regímenes sin IFN son las únicas opciones en pacientes con infección por el VHC monoinfectados y coinfectados por el VIH con cirrosis descompensada (Child-Pugh B o C), con o sin indicación de trasplante de hígado, y en pacientes después del trasplante de hígado debido a de su eficacia virológica, facilidad de uso, seguridad y tolerabilidad.
- Los regímenes que contienen inhibidores de proteasa están contraindicados en pacientes con cirrosis descompensada (Child-Pugh B o C).
Pacientes con cirrosis descompensada, sin CHC, con indicación de trasplante hepático
Recomendaciones
- Los pacientes con cirrosis descompensada (Child-Pugh B o C) deben tratarse en centros con experiencia, con fácil acceso al trasplante de hígado y se requiere una estrecha vigilancia durante el tratamiento, con la posibilidad de interrumpir el tratamiento con evidencia de empeoramiento de la descompensación durante el tratamiento.
- Los pacientes con cirrosis descompensada (Child-Pugh B o C), sin HCC, en espera de trasplante hepático con una puntuación MELD <18–20 deben ser tratados antes del trasplante hepático. El tratamiento debe iniciarse tan pronto como sea posible para completar un curso de tratamiento completo antes del trasplante y evaluar el efecto de la RVS en la función hepática, ya que una mejora significativa en la función hepática puede llevar a la exclusión de la lista en algunos casos.
- Los regímenes que contienen inhibidores de proteasa están contraindicados en pacientes con cirrosis descompensada (Child-Pugh B o C).
- Los pacientes con cirrosis descompensada (Child-Pugh B o C), sin HCC, en espera de trasplante hepático con una puntuación MELD <18-20 pueden tratarse con sofosbuvir y ledipasvir (genotipos 1, 4, 5 y 6) o con sofosbuvir y velpatasvir (todos los genotipos), con ribavirina basada en el peso diario (1.000 o 1.200 mg en pacientes <75 kg o ≥75 kg, respectivamente) durante 12 semanas.
- En pacientes con cirrosis descompensada (Child-Pugh B o C) sin HCC en espera de trasplante hepático con una puntuación MELD <18-20 tratados con sofosbuvir y ledivavirin con ribavirina, o con sofosbuvir y velpatasvir con ribavirina, se puede iniciar con ribavirina a la dosis de 600 mg diarios y la dosis posteriormente ajustada en función de la tolerancia.
- Los pacientes con cirrosis descompensada (Child-Pugh B o C) con contraindicaciones para el uso de ribavirina o con poca tolerancia a la ribavirina en el tratamiento deben recibir la combinación de dosis fija de sofosbuvir y ledipasvir (genotipos 1, 4, 5 o 6) , o la combinación de dosis fija de sofosbuvir y velpatasvir (todos los genotipos), durante 24 semanas sin ribavirina.
- El mayor riesgo de eventos adversos informados en pacientes con cirrosis descompensada en espera de trasplante hepático requiere evaluaciones clínicas y de laboratorio con la frecuencia adecuada durante y después del tratamiento del VHC.
- Los pacientes con cirrosis descompensada sin HCC que esperan un trasplante de hígado con una puntuación MELD ≥18-20 deben ser trasplantados primero, sin tratamiento antiviral. La infección por VHC debe tratarse después de un trasplante de hígado.
- Los pacientes con cirrosis descompensada sin HCC que esperan un trasplante de hígado con una puntuación MELD ≥18-20 pueden ser tratados antes del trasplante si el tiempo de espera en la lista de trasplantes supera los 6 meses, dependiendo de la situación local.
Pacientes con CHC, sin cirrosis o con cirrosis compensada, con indicación de trasplante hepático
Recomendaciones
- En pacientes con CHC que esperan trasplante de hígado con una infección por VHC, el trasplante de hígado debe considerarse como el objetivo terapéutico principal y la decisión de tratamiento antiviral debe realizarse caso por caso a través de una discusión multidisciplinaria.
- El tratamiento antiviral puede iniciarse antes del trasplante hepático para prevenir la recurrencia de la infección y las complicaciones posteriores al trasplante, siempre que no interfiera con el manejo del paciente en la lista de espera.
- El tratamiento antiviral puede retrasarse hasta después del trasplante, con una alta probabilidad de RVS.
- Los pacientes con CHC sin cirrosis o con cirrosis compensada (Child-Pugh A) en espera de trasplante de hígado deben tratarse, antes o después del trasplante de hígado, de acuerdo con las recomendaciones generales en pacientes sin CHC.
Recurrencia postrasplante hepático
Recomendaciones
- Todos los pacientes con recidiva postrasplante de infección por VHC deben considerarse para terapia.
- El tratamiento debe iniciarse temprano después del trasplante hepático, idealmente tan pronto como sea posible cuando el paciente está estabilizado (generalmente después de los primeros 3 meses posteriores al trasplante), porque las tasas de RVS12 disminuyen en pacientes con enfermedad hepática postransplante avanzada.
- La hepatitis colestásica fibrosante o la presencia de moderada a fibrosis extensa o hipertensión portal un año después del trasplante indican un tratamiento antiviral urgente porque predicen la progresión rápida de la enfermedad y la pérdida del injerto.
- Los niveles de fármacos inmunosupresores durante y después de la terapia anti-VHC deben ser monitoreados.
- Los pacientes con recidiva del VHC después del trasplante sin cirrosis, con cirrosis compensada (Child-Pugh A) o con cirrosis descompensada (Child-Pugh B o C) pueden tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir (genotipos 1, 4, 5 o 6), o con la combinación de dosis fija de sofosbuvir y velpatasvir (todos los genotipos).
- Los pacientes con recidiva postrasplante de infección por VHC genotipo 1, 4, 5 o 6, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y ledivastvir. o la combinación de dosis fija de sofosbuvir y velpatasvir durante 12 semanas, sin la necesidad de ajustes de la dosis del fármaco inmunosupresor previo al tratamiento.
- Los pacientes con recidiva postrasplante de VHC genotipo 2 o 3, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la combinación de dosis fija de sofosbuvir y velpatasvir durante 12 semanas, sin la necesidad de tratamiento previo. Tratamiento inmunosupresor con ajustes de dosis del fármaco.
- Los pacientes con recurrencia postrasplante de todos los genotipos del VHC, sin cirrosis o con cirrosis compensada (Child-Pugh A), con un eGFR <30 ml/min/1,73 m2 pueden tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas. Los niveles de medicamentos inmunosupresores deben ser monitoreados y ajustados según sea necesario durante y después del tratamiento.
- Los pacientes con recidiva del VHC después del trasplante con cirrosis descompensada (Child-Pugh B o C) deben tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir (genotipos 1, 4, 5 o 6), o con la combinación de dosis fija de sofosbuvir y velpatasvir (todos los genotipos), durante 12 semanas con ribavirina basada en el peso diario (1.000 o 1.200 mg en pacientes <75 kg o ≥75 kg, respectivamente). En estos pacientes, la ribavirina puede iniciarse con una dosis de 600 mg al día y, posteriormente, ajustarse en función de la tolerancia.
- Los pacientes con cirrosis descompensada (Child-Pugh B o C) y contraindicaciones para la ribavirina, o con poca tolerancia a la ribavirina en el tratamiento, deben tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir (genotipos 1, 4, 5 o 6) o la combinación de dosis fija de sofosbuvir y velpatasvir (todos los genotipos) durante 24 semanas sin ribavirina.
Pacientes con cirrosis descompensada sin indicación de trasplante hepático
Recomendaciones
- Los pacientes con cirrosis descompensada (Child-Pugh B y Child-Pugh C hasta 12 puntos) que no están en lista de espera para trasplante de hígado y sin comorbilidades concomitantes que podrían afectar su supervivencia deben tratarse con urgencia.
- Los regímenes que contienen inhibidores de proteasa están contraindicados en pacientes con cirrosis descompensada Child-Pugh B o C.
- Los pacientes con cirrosis descompensada, que no están en la lista de espera para trasplante de hígado, pueden tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir (genotipos 1, 4, 5 o 6) o la combinación de dosis fija de sofosbuvir y velpatasvir (todos los genotipos) con ribavirina basada en el peso diario (1.000 o 1.200 mg en pacientes <75 kg o ≥75 kg, respectivamente). En estos pacientes, la ribavirina puede iniciarse con una dosis diaria de 600 mg y posteriormente ajustarse según la tolerancia.
- Los pacientes con cirrosis descompensada que no estén en la lista de espera para trasplante de hígado deben ser tratados con sofosbuvir y ledipasvir (genotipos 1, 4, 5 o 6) o con sofosbuvir y velpatasvir (todos los genotipos) durante 12 semanas con ribavirina.
- Los pacientes con cirrosis descompensada que no están en la lista de espera para trasplante de hígado con contraindicaciones para la ribavirina, o con poca tolerancia a la ribavirina en el tratamiento, pueden recibir la combinación de dosis fija de la combinación de dosis fija de sofosbuvir y velpatasvir (todos los genotipos) por 24 semanas sin ribavirina.
- El mayor riesgo de eventos adversos informados en pacientes con cirrosis descompensada requiere evaluaciones clínicas y de laboratorio con la frecuencia adecuada durante y después del tratamiento contra el VHC.
Pacientes con CHC tratados sin indicación de trasplante hepático
Recomendaciones
- El tratamiento contra el VHC no debe ser retenido en pacientes con cirrosis y estos pacientes requerirán vigilancia posterior a la RVS de CHC, porque el riesgo de CHC de novo o incidente se reduce pero no se elimina por la RVS.
- Se desconoce si la terapia antiviral conduce a un beneficio de supervivencia a largo plazo al reducir el riesgo de CHC recurrente en pacientes con CHC asociado a VHC tratado. Sin embargo, estos pacientes con frecuencia presentan fibrosis o cirrosis avanzada y deben recibir una terapia antiviral adecuada para su enfermedad hepática, mientras que en estos pacientes se requiere una cuidadosa vigilancia del CHC.
Tratamiento de grupos especiales
Coinfección por VHB
Recomendaciones
- Los pacientes con coinfección por VHB-VHC deben tratarse con los mismos regímenes anti-VHC, siguiendo las mismas reglas que los pacientes con infección por VHC.
- Los pacientes coinfectados con VHC y VHB que cumplen con los criterios estándar para el tratamiento con VHB deben recibir un tratamiento análogo de nucleósido / nucleótido de acuerdo con las Pautas de Práctica Clínica de la EASL 2017 sobre el tratamiento de la infección por el virus de la hepatitis B.
- Los pacientes que son positivos para el antígeno HBs deben recibir profilaxis análogos de nucleósidos / nucleótidos al menos hasta la semana 12 después de la terapia anti-VHC y ser monitoreados mensualmente si se suspende el tratamiento.
- En pacientes con antígeno HBs negativo pero anticuerpos anti-HBc positivos, los niveles séricos de ALT deben monitorizarse mensualmente, el antígeno HBs y el ADN del VHB deben analizarse si los niveles de ALT no se normalizan o aumentan durante o después de la terapia anti-VHC y debe iniciarse la terapia análoga de nucleósido / nucleótido si el antígeno HBs y/o el ADN del VHB están presentes.
- Los pacientes con antígeno HBs negativo, anticuerpos anti-HBc positivos que se someten a un tratamiento anti-VHC deben ser monitoreados mensualmente para ALT y analizados para detectar el antígeno HBs y el ADN del VHB en caso de elevación de ALT.
Manifestaciones mediadas por complejos inmunes de la hepatitis C crónica
Recomendaciones
- La crioglobulinemia mixta y la enfermedad renal asociadas con la infección crónica por VHC deben tratarse con combinaciones de anti-VHC basadas en AADs sin IFN, sin ribavirina, de acuerdo con las recomendaciones anteriores. El monitoreo cuidadoso de los eventos adversos es obligatorio.
- La indicación de rituximab en la enfermedad renal relacionada con el VHC debe ser discutida por un equipo multidisciplinario.
- El linfoma asociado al VHC debe tratarse con regímenes libres de IFN, sin ribavirina, de acuerdo con las recomendaciones anteriores, en combinación con quimioterapia específica, teniendo en cuenta las posibles interacciones entre medicamentos.
Pacientes con insuficiencia renal, incluidos los pacientes en hemodiálisis
Recomendaciones
- Los pacientes con infección por VHC y insuficiencia renal leve a moderada (eGFR ≥30 ml/min/1,73 m2) deben tratarse de acuerdo con las recomendaciones generales. No se necesitan ajustes de dosis de los AAD del VHC, pero estos pacientes deben ser monitoreados cuidadosamente.
- Los pacientes con insuficiencia renal grave (eGFR <30 ml/min/1,73 m2) y los pacientes con enfermedad renal en etapa terminal en hemodiálisis deben ser tratados en centros de expertos, con un monitoreo cercano por un equipo multidisciplinario.
- Sofosbuvir se debe usar con precaución en pacientes con un eGFR <30 ml/min/1,73 m2 o con enfermedad renal terminal, sólo si no hay un tratamiento alternativo disponible, ya que actualmente no se puede recomendar una dosis para estos pacientes.
- Los pacientes infectados con todos los genotipos con insuficiencia renal grave (eGFR <30 ml/min/1,73 m2), o con enfermedad renal terminal en hemodiálisis, sin indicación de trasplante de riñón, deben tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 8 o 12 semanas, de acuerdo con las recomendaciones generales.
- Pacientes infectados con el genotipo 1a del VHC y los pacientes sin tratamiento previo infectados con el genotipo 4 con insuficiencia renal grave (TFG <30 ml/min/1,73 m2) o con enfermedad renal terminal en hemodiálisis, sin indicación de trasplante renal y con el nivel de ARN del VHC ≤800,000 UI/ml (5,9 log10 UI/ml) se puede tratar con la combinación de grazoprevir y elbasvir durante 12 semanas.
- Los pacientes infectados con el genotipo 1b del VHC con insuficiencia renal grave (TFG <30 ml/min/1,73 m2) o con enfermedad renal terminal en hemodiálisis, sin indicación de trasplante renal, pueden tratarse con la combinación de grazoprevir y elbasvir para 12 semanas, o con la combinación de paritaprevir, ombitasvir y dasabuvir potenciados con ritonavir durante 12 semanas.
- Los riesgos frente a los beneficios del tratamiento de pacientes con enfermedad renal terminal y una indicación de trasplante renal antes o después del trasplante renal requieren una evaluación individual.
Receptores de trasplante de órganos sólidos no hepáticos
Recomendaciones
- Los receptores de trasplantes de órganos sólidos, incluidos los receptores de riñón, corazón, pulmón, páncreas o intestino delgado, deben recibir tratamiento por su infección por el VHC antes o después de la implantación, siempre que su esperanza de vida sea superior a un año.
- Antes del trasplante de riñón, corazón, pulmón, páncreas o intestino delgado, los pacientes en lista de espera pueden ser tratados de acuerdo con las recomendaciones generales anteriores, según el genotipo, la gravedad de la enfermedad hepática y el tratamiento previo contra el VHC.
- Después del trasplante, los receptores de trasplantes de órganos sólidos, incluidos los de riñón, corazón, pulmón, páncreas o intestino delgado, deben tratarse con la combinación de dosis fija de sofosbuvir y ledipasvir (genotipos 1, 4, 5 y 6) o con la dosis fija de combinación de dosis de sofosbuvir y velpatasvir (todos los genotipos) de acuerdo con las recomendaciones generales, sin la necesidad de ajustes inmunosupresores de la dosis del fármaco.
- Después del trasplante, los receptores de trasplantes de órganos sólidos, incluidos los receptores de riñón, corazón, pulmón, páncreas o intestino delgado, con un eGFR <30 ml/min/1,73 m2, pueden tratarse con la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas. Los niveles de medicamentos inmunosupresores deben ser monitoreados y ajustados según sea necesario durante y después del final del tratamiento.
Receptores de un trasplante de órgano VHC positivo
Recomendaciones
- Los órganos de los anticuerpos positivos al anticuerpo anti-VHC y los donantes positivos al ARN del VHC pueden trasplantarse a receptores positivos al ARN del VHC.
- El uso de anticuerpos anti-VHC positivos, órganos positivos al ARN del VHC para los receptores negativos del ARN del VHC es posible, siempre que se permita la normativa local, se obtenga un consentimiento informado riguroso y se garantice una rápida terapia AADs postrasplante.
- No se recomienda el uso de injertos de hígado con fibrosis moderada (F2) o avanzada (F3).
Personas que se inyectan drogas y pacientes que reciben terapia de sustitución de opioides
Recomendaciones
- Las PQID deben someterse a pruebas rutinarias y voluntarias para detectar anticuerpos anti-VHC y ARN del VHC. Las PQID que son negativas para el ARN del VHC deben analizarse anualmente para el ARN del VHC y después de cualquier episodio de inyección de alto riesgo.
- Las PQID deben contar con acceso adecuado a OST y equipo limpio de inyección de drogas como parte de programas de reducción de daños integrales y generalizados, incluso en las cárceles.
- Todas las PQID que están infectadas con VHC tienen una indicación de terapia antiviral, ya que las terapias basadas en AADs son seguras y efectivas en pacientes infectados con VHC que reciben OST, aquellos con un historial de uso de drogas inyectables y los que se inyectaron recientemente.
- El tratamiento contra el VHC debe ofrecerse a los pacientes infectados por el VHC en prisión.
- La educación preterapéutica debe incluir discusiones sobre la transmisión del VHC, los factores de riesgo para la progresión de la fibrosis, el tratamiento, el riesgo de reinfección y las estrategias de reducción de daños.
- En pacientes en tratamiento con OST, la terapia anti-VHC basada en AADs no requiere un ajuste de dosis de metadona o buprenorfina.
- La reducción de daños, la educación y el asesoramiento deben proporcionarse a las PQID en el contexto del tratamiento del VHC para prevenir la reinfección del VHC después de un tratamiento exitoso.
- Después de la RVS, el monitoreo de la reinfección del VHC idealmente a través de una evaluación bianual, al menos anual de ARN del VHC se debe realizar en PQID con un comportamiento de riesgo continuo.
- El retratamiento debe estar disponible, si la reinfección se identifica durante el seguimiento posterior a la RVS.
Hemoglobinopatías y trastornos hemorrágicos
Recomendaciones
- Las indicaciones para el tratamiento del VHC son las mismas en pacientes con hemoglobinopatías o trastornos hemorrágicos.
- Los regímenes anti-VHC libres de IFN y de ribavirina que se pueden usar en pacientes con hemoglobinopatías o trastornos hemorrágicos son los mismos que en pacientes sin hemoglobinopatías o trastornos hemorrágicos.
Adolescentes y niños
Recomendaciones
- Los adolescentes de 12 años y más de edad infectados con genotipo 1, 4, 5 o 6 que no han recibido tratamiento o que han recibido tratamiento, sin cirrosis o con cirrosis compensada (Child-Pugh A), deben tratarse con la dosis fija de combinación de sofosbuvir (400 mg) y ledipasvir (90 mg) durante 12 semanas.
- Los adolescentes de 12 años y más de edad infectados con genotipo 2 o 3 que no han recibido tratamiento o que han recibido tratamiento, sin cirrosis o con cirrosis compensada (Child-Pugh A), pueden tratarse con otros regímenes aprobados para adultos, con precaución a la espera de más datos de seguridad en esta población.
- En niños menores de 12 años, el tratamiento debe aplazarse hasta que los AAD, incluidos los regímenes pangenotípicos, estén aprobados para este grupo de edad.
Retratamiento de respondedores virológicos no sostenidos
Recomendaciones
- Los pacientes que fallaron después del tratamiento combinado con IFN-a y ribavirina, IFN-a pegilado, ribavirina y sofosbuvir, o sofosbuvir y ribavirina combinados deben volver a tratarse de acuerdo con las recomendaciones anteriores para pacientes con experiencia en el tratamiento, por genotipo del VHC.
- La prueba de resistencia al VHC antes del retratamiento en pacientes que fracasaron después de cualquiera de los regímenes de tratamiento que contienen AADs es útil para guiar el retratamiento según las probabilidades de respuesta, de acuerdo con el perfil de resistencia observado en el contexto de un equipo multidisciplinario que incluye tratadores con experiencia y virólogos.
- Los pacientes sin cirrosis o con cirrosis compensada (Child-Pugh A) que fracasaron después de un régimen que contenga AADs (inhibidor de proteasa y/o inhibidor de NS5A) deben volver a tratarse con la combinación de dosis fija de sofosbuvir, velpatasvir y voxilaprevir durante 12 semanas, idealmente en el contexto de un equipo multidisciplinario que incluye tratadores experimentados y virólogos.
- Pacientes sin cirrosis o con cirrosis compensada (Child-Pugh A) que fracasaron después de un régimen que contenía AADs (inhibidor de la proteasa y/o inhibidor de NS5A) y tienen factores predictivos de respuesta más baja (enfermedad hepática avanzada, tratamientos múltiples de AADs). Tratamiento basado en el complejo (perfil NS5A RAS complejo) se puede volver a tratar con la combinación de sofosbuvir más la combinación de dosis fija de glecaprevir y pibrentasvir durante 12 semanas, en base a una decisión individual en el contexto de un equipo multidisciplinario que incluye tratadores con experiencia y virólogos.
- En pacientes muy difíciles de curar (pacientes con RAS con NS5A que fallaron dos veces para lograr la RVS después de un régimen de combinación que incluye una proteasa y/o un inhibidor de NS5A), la combinación triple de sofosbuvir, velpatasvir y voxilaprevir, o la combinación triple de sofosbuvir, glecaprevir y pibrentasvir se puede administrar durante 12 semanas con ribavirina basada en el peso (1.000 o 1.200 mg en pacientes <75 kg o ≥75 kg, respectivamente) y/o la duración del tratamiento puede prolongarse de 16 a 24 semanas, basado en una decisión individual en el contexto de un equipo multidisciplinario que incluye tratadores experimentados y virólogos.
- Los pacientes con cirrosis descompensada (Child-Pugh B o C) que fracasaron después de un régimen que contenía AADs (inhibidor de proteasa y/o inhibidor de NS5A) tienen una contraindicación para el uso de inhibidores de proteasa y, por lo tanto, deben volver a tratarse con la combinación de dosis fija de sofosbuvir y velpatasvir con ribavirina basada en el peso (1.000 o 1.200 mg en pacientes <75 kg o ≥75 kg, respectivamente) durante 24 semanas, según una decisión individual en el contexto de un equipo multidisciplinario incluyendo tratadores experimentados y virólogos.
Tratamiento de la hepatitis C aguda
Recomendaciones
- Los pacientes con hepatitis C aguda deben tratarse con una combinación de sofosbuvir y ledipasvir (genotipos 1, 4, 5 y 6) o una combinación de paritaprevir potenciado con ritonavir, ombitasvir y dasabuvir (genotipo 1b) durante 8 semanas.
- Según las similitudes con la hepatitis C crónica, los pacientes con hepatitis C aguda pueden tratarse con una combinación de sofosbuvir y velpatasvir (todos los genotipos), una combinación de glecaprevir y pibrentasvir (todos los genotipos), o una combinación de grazoprevir y elbasvir (genotipos 1b y 4) durante 8 semanas.
- La RVS debe evaluarse a las 12 y 24 semanas después del tratamiento, ya que se han informado recaídas tardías.
- No hay indicaciones para la terapia antiviral como profilaxis posterior a la exposición en ausencia de transmisión documentada del VHC.
Seguimiento del tratamiento
Recomendaciones
- Se debe utilizar un método molecular sensible con un límite de detección inferior ≤15 UI/ml para controlar los niveles de ARN del VHC en suero o plasma.
- En los países de ingresos bajos o medios y en los ajustes específicos en los países de ingresos altos, se puede utilizar un análisis de ARN del VHC cualitativo con un límite de detección inferior ≤1000 UI/ml (3,0 Log10 UI/ml) para proporcionar una cobertura amplia y asequible. Acceso al diagnóstico y atención del VHC.
- La medición de los niveles de antígeno central del VHC en suero o plasma mediante EIA se puede utilizar como una alternativa a la medición del nivel de ARN del VHC para controlar la eficacia del tratamiento cuando los ensayos de ARN del VHC no están disponibles y/o no son asequibles.
- En pacientes tratados con un régimen sin IFN, los niveles de antígeno del VHC o ARN del VHC deben medirse en la línea de base y 12 o 24 semanas después del final de la terapia (para evaluar la RVS12 o la RVS24, respectivamente).
- En algunas partes del mundo, dadas las altas tasas de RVS12 esperadas con los regímenes basados en AADs, el control de la RVS puede ser prescindible, excepto en pacientes con comportamientos de alto riesgo y riesgo de reinfección.
Seguimiento de la seguridad del tratamiento
Recomendaciones
- Los pacientes que reciben un régimen que contiene AADs deben ser evaluados para detectar efectos secundarios clínicos en cada visita.
- Los niveles de ALT deben evaluarse al menos al inicio del estudio y a las 12 o 24 semanas posteriores al tratamiento, y en caso de síntomas sugestivos.
- El monitoreo de los aumentos indirectos de bilirrubina debe realizarse en pacientes que reciben la combinación de paritaprevir, ombitasvir y dasabuvir potenciados con ritonavir.
- La función renal debe verificarse mensualmente en pacientes con eGFR reducido que reciben sofosbuvir.
- Se han observado exposiciones más altas con los inhibidores de la proteasa en pacientes con insuficiencia hepática grave y el uso de regímenes que contienen inhibidores de la proteasa (glecaprevir y pibrentasvir; grazoprevir y elbasvir; paritaprevir reforzado con ritonavir; en pacientes con cirrosis descompensada de Child-Pugh B y C.
Monitoreo de interacciones medicamentosas
Recomendaciones
- La eficacia y la toxicidad de los fármacos concurrentes administrados para las comorbilidades y las posibles interacciones farmacológicas deben controlarse durante el tratamiento.
- Cuando sea posible, debe interrumpirse la administración de un medicamento combinado durante la duración del tratamiento contra el VHC o la aplicación de dicho medicamento debe cambiarse a un medicamento alternativo con menos potencial de interacción.
Tratamiento de reducciones de dosis
Recomendaciones
- El tratamiento debe interrumpirse en caso de eventos adversos graves o en caso de brote ALT> 10 veces el límite superior de los valores normales.
- En pacientes que necesitan ribavirina (pacientes con cirrosis descompensada [Child-Pugh B o C]), la dosis de ribavirina debe ajustarse hacia abajo en 200 mg en decrementos si el nivel de hemoglobina cae por debajo de 10 g/dl. La administración de ribavirina debe interrumpirse si los niveles de hemoglobina descienden por debajo de 8,5 g/dl.
Medidas para mejorar la adherencia al tratamiento
Recomendaciones
- El tratamiento contra el VHC debe administrarse en un entorno de equipo multidisciplinario, con experiencia en evaluación y terapia del VHC.
- Los pacientes infectados por el VHC deben ser informados sobre la importancia de la adherencia para alcanzar una RVS.
- En pacientes con desventajas socioeconómicas y en migrantes, los servicios de apoyo social deben ser un componente del manejo clínico del VHC.
- Se recomienda el apoyo basado en pares y la evaluación de la activación del paciente para mejorar la gestión clínica del VHC.
- Los pacientes con consumo nocivo de alcohol durante el tratamiento deben recibir apoyo adicional durante la terapia antiviral.
Seguimiento postratamiento de pacientes que logran una RVS
Recomendaciones
- Los pacientes con fibrosis no moderada (puntuación METAVIR F0-F2), con RVS y sin conductas de riesgo continuas deben ser dados de alta, siempre que no tengan otras comorbilidades.
- Los pacientes con fibrosis avanzada (F3) o cirrosis (F4) con RVS deben someterse a vigilancia por HCC cada 6 meses mediante ecografía.
- En pacientes con cirrosis, se debe realizar una vigilancia de las várices esofágicas mediante endoscopia si las várices estuvieron presentes en la endoscopia previa al tratamiento, aunque el sangrado variceal índice rara vez se observa en pacientes de bajo riesgo después de alcanzar la RVS (a menos que se detecten causas adicionales de daño hepático continuo presente y persistente).
- Se debe explicar el riesgo de reinfección, para modificar positivamente el comportamiento de riesgo.
- Después de la RVS, el monitoreo para la reinfección del VHC idealmente a través de una evaluación bianual, al menos anual de ARN del VHC debe realizarse en personas que se inyectan drogas (PQID) o en hombres que tienen relaciones sexuales con hombres con un comportamiento de riesgo continuo.
- El retratamiento debe estar disponible, si la reinfección se identifica durante el seguimiento posterior a la RVS.
Seguimiento de pacientes no tratados y de pacientes con fracaso terapéutico
Recomendaciones
- Los pacientes no tratados con hepatitis C crónica y aquellos que fallaron el tratamiento previo deben ser seguidos regularmente.
- Los métodos no invasivos para la estadificación de la fibrosis son los más adecuados para la evaluación de seguimiento a intervalos de 1 a 2.
- La vigilancia de CHC cada 6 meses debe continuarse indefinidamente en pacientes con fibrosis avanzada (F3) y cirrosis.
Fuente: Journal of Hepatology
Artículo traducido y adaptado por ASSCAT
