El multiverso de desarrollo de vacunas COVID-19
Dejando a su paso más de 12 millones de infecciones, más de 550.000 muertes y un coste económico de miles de millones de dólares hasta la fecha, la pandemia del SARS-CoV-2 ha devastado a los más vulnerables en nuestra sociedad: adultos de 65 años de edad o mayores, personas con afecciones subyacentes y personas con pocos recursos económicos.
Se necesita urgentemente una vacuna para prevenir la COVID-19 y, por lo tanto, detener las complicaciones y muertes resultantes de la transmisión de la enfermedad.
Jackson y col. informan ahora en el The New England Journal of Medicine los hallazgos preliminares de un ensayo de fase 1 para evaluar la seguridad e inmunogenicidad de una vacuna mRNA SARS-CoV-2. La fase 1 involucra a 45 adultos sanos, de 18 a 55 años de edad, que fueron asignados recibir la vacuna candidata en uno de los tres niveles de dosis (25 μg, 100 μg o 250 μg) administrados en dos vacunas con 28 días de diferencia. Estos hallazgos preliminares representan el primero de tres informes de datos de un estudio de fase 1 de esta vacuna candidata. También se planea un segundo informe que incluye datos similares de adultos mayores de 55 años y un informe final que resume la seguridad y durabilidad de la inmunidad para ambas cohortes de estudio.
La velocidad con la que se ha desarrollado esta vacuna es notable: desde la publicación de las primeras secuencias de SARS-CoV-2 hasta la fase 1 en 6 meses, en comparación con una línea de tiempo típica de 3 a 9 años (Fig. 1). El rápido ritmo de desarrollo de vacunas contra la COVID-19 está habilitado por varios factores: conocimiento previo del papel de la proteína espiga en la patogénesis del coronavirus y evidencia de que el anticuerpo neutralizante contra la proteína espiga es importante para la inmunidad; la evolución de las plataformas tecnológicas de vacunas de ácido nucleico que permiten la creación de vacunas y la pronta fabricación de miles de dosis una vez que se conoce una secuencia genética; y actividades de desarrollo que pueden llevarse a cabo en paralelo, en lugar de secuencialmente, sin aumentar los riesgos para los participantes del estudio.
Figura 1. Vía tradicional de desarrollo de vacunas
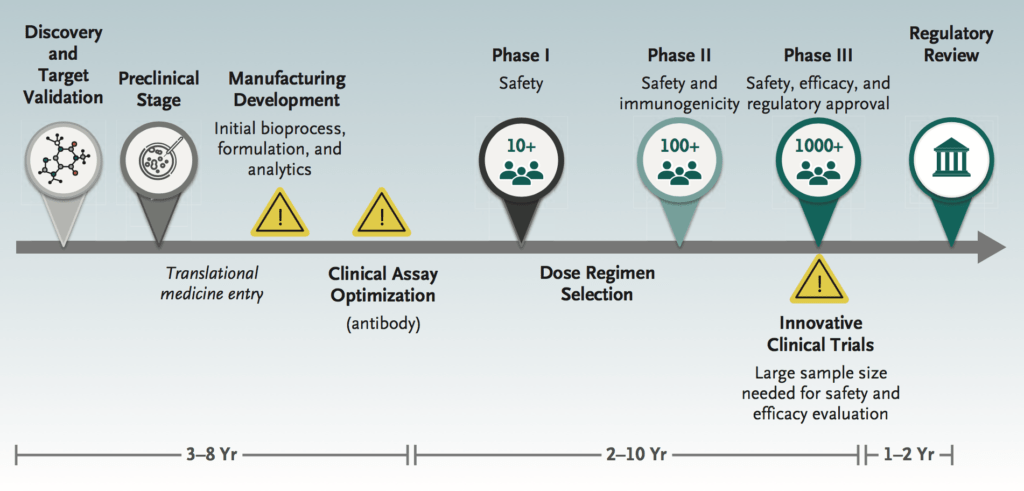
Los datos de seguridad e inmunogenicidad en este informe preliminar son prometedores y respaldan el desarrollo continuo de esta vacuna. Sin embargo, debemos tener en cuenta la complejidad del desarrollo de la vacuna y el trabajo que queda por hacer antes de que las vacunas COVID-19 estén ampliamente disponibles.
Muchos estudios de fase 3 fallan debido a la identificación incorrecta de la dosis que mejor equilibra la seguridad y la eficacia. El régimen de dosificación para esta vacuna de ARNm aún está en estudio. La dosis de 250 μg no parecía estar asociada con títulos de anticuerpos marcadamente más altos que la dosis de 100 μg, pero estaba asociada con una mayor proporción de eventos adversos sistémicos graves. Como indican los investigadores, es prudente evaluar dosis de 100 μg y menos para definir el régimen que proporciona el perfil de riesgo-beneficio más apropiado para esta vacuna. Otra consideración especial de dosificación en este caso es la edad: las funciones inmunes que disminuyen con la edad y que probablemente sean responsables del mayor riesgo de COVID-19 grave en los adultos mayores también pueden dar lugar a respuestas deficientes de la vacuna. ¿Se necesitará una dosis alta de la vacuna COVID-19 para la protección efectiva de los adultos mayores, como se observa con las vacunas para la influenza?
Será necesario confirmar la importancia clínica de los títulos de anticuerpos neutralizantes y de unión al SARS-CoV-2 y su capacidad para predecir la eficacia. Estas medidas se están utilizando actualmente para guiar la selección de dosis antes de ser verificadas; son las mejores herramientas disponibles y están respaldadas por hallazgos en primates no humanos. La confirmación de la correlación entre los títulos de anticuerpos y la protección contra la COVID-19 sólo será posible en un gran estudio de eficacia clínica. Mientras tanto, también será necesario documentar la validez de los ensayos para medir el anticuerpo. Estos ensayos son notoriamente variables porque usan virus vivos o expresión de proteínas en cultivos celulares con una lectura que se basa en una reacción biológica in vitro (es decir, la unión de anticuerpos séricos o la eliminación del antígeno viral). La optimización de las características de rendimiento de estos ensayos será invaluable para agilizar el desarrollo y apoyar el puente a través de poblaciones y procesos de fabricación variados.
Los autores indican que es inminente un ensayo planificado de fase 3 de esta vacuna de ARNm SARS-CoV-2. El ensayo requerirá miles de sujetos para confirmar la seguridad de la vacuna y mostrar una eficacia estadísticamente sólida en la prevención de la COVID-19. La complejidad operativa inherente a un gran estudio se ve agravada por las ondulaciones de la pandemia; la eficacia sólo se puede determinar si existe una coincidencia entre la ubicación de los participantes vacunados y los puntos calientes de la pandemia. La incertidumbre con respecto al perfil de eficacia esperado también genera complejidad. Los perfiles observados para otras vacunas virales sugieren que la eficacia contra la COVID-19 grave puede ser mayor que la eficacia contra la enfermedad leve. Se debe considerar la selección cuidadosa de los puntos finales primarios y los diseños de estudio basados en eventos con la posibilidad de reestimar el tamaño de la muestra.
Acelerar el desarrollo de los candidatos a la vacuna COVID-19 más allá de la fase 1 depende del seguimiento paralelo continuo de las actividades y de los abundantes recursos. El mundo ha sido testigo de la compresión de 6 años de trabajo en 6 meses. ¿Puede la vacuna multiverso volver a hacerlo, dando lugar a una realidad de una vacuna segura y eficaz de COVID-19 para los más vulnerables en los próximos 6?
Para leer el artículo original, clicar aquí.
Fuente: The New England Journal of Medicine
Referencia: DOI: 10.1056/NEJMe2025111
Artículo traducido por ASSCAT
